Un atome est constitué d'un noyau chargé + et d'éléctrons chargés - en mouvement autour du noyau. L'atome est éléctriquement neutre.
Un noyau est constitué de particules appelées nucléons de deux types : - des neutrons (neutres)
- des protons (chargés +)
Comme l'atome est éléctriquement neutre, il y autant de charges + que de charges -. Il y a donc autant d'éléctrons que de protons. La charge éléctrique portée par le proton est appelée charge élémentaire (e).
e = 1.6*10-19 J
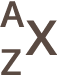 A : nombre de nucléons (protons et neutrons)
A : nombre de nucléons (protons et neutrons)
Z : numero atomique (nombre de protons donc nombre d'éléctrons)
Si N est le nombre de neutrons :
A = Z + N
La matière constituant un atome est essentiellement concentrée dans son noyau. Les distances séparant le noyau des éléctrons sont très grandes. Ainsi, la plus grande partie de l'atome est constituée de vide.
C'est une structure lacunaire.
Dimensions de l'atome d'hydrogène :
diamètre du noyau : dN = 2.4*10-15 m
diamétre de l'atomes : dA = 1.1*10-10 m
Le diamètre de l'atome est donc 100 000 fois plus grand que celui de son noyau.
La masse de l'atome est égale au nombre de nucléons (A) multipliée par leur masse qui est la même pour les protons et les neutrons. On ne prends pas en compte la masse des éléctrons dans le calcul car leur masse est négligable.
La répartition des éléctrons n'est pas homogène. Dans un modèle simplifié, on peut considérer qu'ils se concentrent sur des couches appelées couches éléctroniques. Trois couches suffisent pour répartir les éléctrons au lyçée (Z <= 18). Chaque couche est repérée par une lettre : K, L, M.
Une couche ne peut contenir qu'un nombre limité d'éléctrons. La couche K (la plus proche) peut contenir deux éléctrons maximum. Les couches L et M peuvent contenir huit éléctrons au maximum. Une couche éléctronique est saturée lorsqu'elle contient son nombre maximum d'éléctrons. Le remplissage des couches commence par la couche K puis L puis M.
La couche la plus éloignée qui contient des éléctrons est appelée couche externe. Les éléctrons de cette couche externe sont les éléctrons périphériques.
Exemple : Structure éléctronique du sodium
11Na : (K)2 (L)8 (M)1 : les couches entre parenthéses et le nombre d'éléctrons en exposant.
Lorqu'un atome perd ou gagne un ou plusieurs éléctrons, il devient un ion monoatomique. Cette transformation concerne uniquement les éléctrons. Un atome et l'ion qui en dérive sont caractérisés par la même
valeur de Z. Un atome éléctriquement neutre qui gagne des éléctrons deviendra un ion négatif (ou anion). Un atomes éléctriquement neutre qui perd des éléctrons deviendra un ion positif (ou cathion). On met en haut à droite
la charge de l'ion :
Cl- (gagne un éléctron)
Fe3+ (perdu trois éléctrons)
Toutes les entités chimiques, atomes ou ions, possédant le même Z appartiennent au même élément chimique. Tout élément chimique est représenté par un symbole qui permet de l'identifier. Le symbole est composé d'une lettre majuscule (ex : Iode : I) ou d'une majuscule suivie d'une minuscule (magnesium : Mg).
La classification périodique des éléments est un tableau qui regroupe tous les éléments connus, classés par numéro atomique croissant.
On appelle atomes isotopes les ensembles d'atomes caractérisés par le même Z mais un nombre de nucléons (A) différent. Ce sont des atomes qui ne différent que par leur nombre de neutrons.