Selon la théorie du Big Bang, les 1ers éléments, hydrogène et helium, se sont assemblés il y a 13.7 milliards d'années. Les éléments ayant un Z plus élevé comme le carbone, l'oxygène et le fer sont ensuite nés au coeur d'étoiles dans des conditions extrèmes de température et de pression. En fin de vie, les étoiles les plus massives explosent et dispersent les éléments sous forme de gaz.
Les réactions chimiques se font sans apparition ni perte d'éléments. Les éléments mis en jeu peuvent éventuellement changer de forme. C'est à dire passer d'un atome à un ion où se combiner avec d'autres atomes. Il y a toujours conservation des éléments au cours d'une réaction chimique.
Mendeleïv eut l'idée de classer les éléments, connus à son époque en colonnes et en lignes par ordre de masse croissante de façon à ce que les éléments ayant des propriétés chimiques semblables figurent dans une même ligne. Il prédit l'existence de certains éléments inconnus à son époque pour expliquer certaines cases vides dans son classement.
Elle est constituée de 18 colonnes et 7 lignes. Les 112 éléments chimiques naturels ou artificiels sont rangés en ligne par ordre croissant. Le remplissage progressif d'une ligne correspond au
remplissage progressif d'une couche éléctronique. Un changement de ligne s'effectue quand la couche est saturée. Les lignes sont appelées des periodes. Dans une même colonne, les atomes ont le
même nombre d'éléctrons sur leur couche éléctronique.
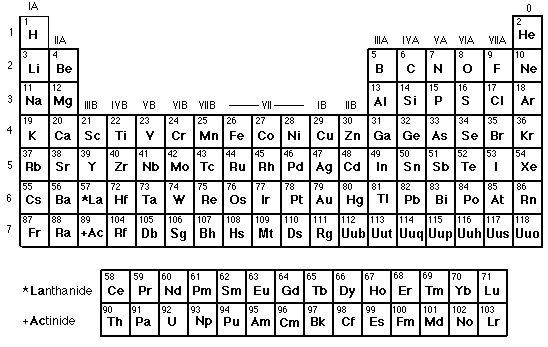
Les propriétés chimiques des éléments dépendent essentiellement du nombre d'éléctrons sur la couche externe. Or les éléments d'une même colonne ont le même nombre d'éléctrons sur leur couche externe.
Ils auront donc les mêmes propriétés. On dit qu'une colonne constitue une famille chimique.
Les familles chimiques sont les suivantes :
| Colonne | I | II | III | IV | V | VI | VII | VIII |
|---|---|---|---|---|---|---|---|---|
| Famille | Métaux alcalins (sauf hydrogène) | Métaux alcalino-terreux | Famille du bore | Famille du carbone | Famille de l'azote | Famille de l'oxygène | Halogènes | Gaz nobles |
| Nombre d'éléctrons périphériques | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 (sauf helium) |
Les structures éléctroniques en duet (couche K saturée) ou en octet (couche L ou M saturée) sont particulièrement stables. La famille des gaz rares possède une structure éléctronique en duet
ou en octet et est inerte.
Règle du duet (Z compris entre 2 et 4 inclus) : Ces atomes tendent à avoir une structure en duet pour avoir la couche K saturée.
Règle de l'octet (Z compris entre 4 exclu et 20 inclu) : Ces atomes tendent à avoir une structure en octet pour avoir la couche L ou M saturée.
Pour trouver la charge des ions :
1ere colonne : 3Li (K)2 (L)1 => perd 1 éléctron de la couche L pour être en duet => Li+
2e colonne : 9F (K)2 (L)7 => gagne 1 éléctron de la couche L pour être en octet => F-